
Seit Jänner 2020 ist in Europa mit MAYZENT® das erste und einzige oral einzunehmende Medikament zur Behandlung der sekundär progredienten Multiplen Sklerose (SPMS) zugelassen. Mayzent® (Wirkstoff: Siponimod) wird angewendet zur Behandlung von erwachsenen Patienten mit sekundär progredienter Multipler Sklerose (SPMS) mit Krankheitsaktivität, nachgewiesen durch Schübe oder Bildgebung der entzündlichen Aktivität1.
Bei ca. 50 % der Patienten mit schubförmig remittierender Multipler Sklerose (RRMS) geht die Erkrankung innerhalb von 15 Jahren in eine sekundär progrediente Phase (SPMS) über2,3. Die fortschreitende und irreversible Behinderungsprogression beeinträchtigt die Lebensqualität der Betroffenen hochgradig, da es zu verschiedensten neurologischen Ausfällen kommt. Das Therapieziel ist, die Abhängigkeit von einem Rollstuhl mit einer wirksamen Therapie so lange als möglich hinauszuzögern. Mayzent® zeigte diesbezüglich in der Zulassungsstudie EXPAND eine signifikante Risikoreduktion von 21% der „nach 3-Monaten bestätigten Behinderungsprogression“ im Vergleich zu Placebo4.
Siponimod ist ein selektiver Sphingosin 1-Phosphat (S1P)-Rezeptor-Modulator: S1P-Rezeptor-1 und S1P-Rezeptor-5. Er wirkt als funktioneller Antagonist auf den S1P Rezeptor-1 der Lymphozyten und verhindert so die Migration von Lymphozyten aus den Lymphknoten. Dies vermindert die Rezirkulation von T-Zellen in das Zentralnervensystem (ZNS), um die Entzündung im ZNS zu begrenzen. Aufgrund der kleinen Molekülgröße durchdringt Siponimod die Blut-Hirnschranke und bindet dort möglicherweise ebenfalls an Lymphozyten, aber auch an Oligodendrozyten, die unter anderem für die Myelinisierung zuständig sind.
Vor Beginn der Behandlung mit Mayzent® muss bei den Patienten der individuelle CYP2C9-Metabolisierungsstatus mittels Genotypisierung bestimmt werden, aus dem die Dosisempfehlung resultiert:
o CYP2C9*2*3 oder *1*3 Genotyp: Erhaltungsdosis 1 mg 1x täglich (vier Tabletten zu 0,25 mg)
o CYP2C9*3*3 Genotyp: Siponimod kontraindiziert
o Alle Patienten mit anderem CYP2C9-Genotyp: Erhaltungsdosis 2 mg 1x täglich
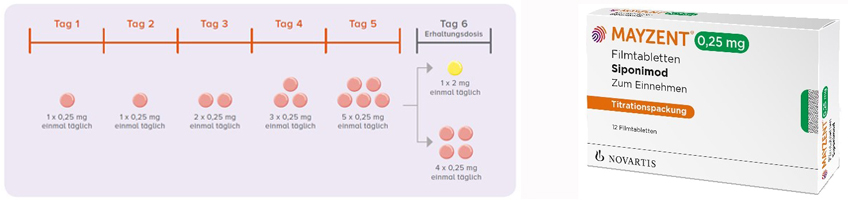
Die Mayzent® Therapie wird schrittweise über einen Zeitraum von 5 Tagen beginnend mit 0,25 mg auftitriert. Dazu steht eine Titrationspackung zur Verfügung. Ab Tag 6 beginnt die Dauertherapie mit der Zieldosis 1 mg oder 2 mg.
FACHKURZINFORMATION: Bezeichnung des Arzneimittels: Mayzent® 0,25 mg Filmtabletten, Mayzent® 2 mg Filmtabletten Qualitative und quantitative Zusammensetzung: Mayzent 0,25 mg Filmtabletten Jede Filmtablette enthält Siponim:odhemifumarat, entsprechend 0,25 mg Siponimod. Sonstiger Bestandteil mit bekannter Wirkung: Jede Tablette enthält 59,1 mg Lactose (als Monohydrat) und 0,092 mg Phospholipide aus Sojabohnen. Mayzent 2 mg Filmtabletten: Jede Filmtablette enthält Siponimodhemifumarat, entsprechend 2 mg Siponimod. Sonstiger Bestandteil mit bekannter Wirkung: Jede Tablette enthält 57,3 mg Lactose (als Monohydrat) und 0,092 mg Phospholipide aus Sojabohnen. Liste der sonstigen Bestandteile: Mayzent 0,25 mg Filmtabletten: Tablettenkern: Lactose-Monohydrat, Mikrokristalline Cellulose, Crospovidon, Glyceroldibehenat (Ph.Eur.), Hochdisperses Siliciumdioxid. Filmüberzug: Poly(vinylalkohol), Titandioxid (E171), Eisen(III)-oxid (E172), Eisen(II,III)-oxid (E172), Talkum, Phospholipide aus Sojabohnen, Xanthangummi. Mayzent 2 mg Filmtabletten: Tablettenkern: Lactose-Monohydrat, Mikrokristalline Cellulose, Crospovidon, Glyceroldibehenat (Ph.Eur.), Hochdisperses Siliciumdioxid. Filmüberzug: Poly(vinylalkohol), Titandioxid (E171), Eisen(III)-hydroxid-oxid x H2O (E172), Eisen(III)-oxid (E172), Talkum, Phospholipide aus Sojabohnen, Xanthangummi. Anwendungsgebiete: Mayzent wird angewendet zur Behandlung von erwachsenen Patienten mit sekundär progredienter Multipler Sklerose (SPMS) mit Krankheitsaktivität, nachgewiesen durch Schübe oder Bildgebung der entzündlichen Aktivität (siehe Abschnitt 5.1). Gegenanzeigen: – Überempfindlichkeit gegen den Wirkstoff, Erdnüsse, Soja oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. – Immundefizienzsyndrom. – Anamnestisch bekannte Progressive Multifokale Leukenzephalopathie oder Kryptokokkenmeningitis. – Aktive maligne Erkrankungen. – Schwere Leberfunktionsstörung (Child-Pugh-Klasse C). – Patienten, die in den letzten 6 Monaten einen Myokardinfarkt (MI), eine instabile Angina pectoris, einen Schlaganfall/eine transitorische ischämische Attacke (TIA), eine dekompensierte Herzinsuffizienz (die eine stationäre Behandlung erforderte) oder eine Herzinsuffizienz der New York Heart Association (NYHA) Klasse III/IV hatten (siehe Abschnitt 4.4). – Patienten mit einem anamnestisch bekannten AV-Block 2. Grades Mobitz Typ II, einem AV-Block 3. Grades, einer sinusatrialen Blockierung oder Sick-Sinus-Syndrom, wenn sie keinen Herzschrittmacher tragen (siehe Abschnitt 4.4). – Patienten, die homozygot für das CYP2C9*3-Allel sind (CYP2C9*3*3-Genotyp; langsame Metabolisierer). – Während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine zuverlässige Verhütungsmethode anwenden (siehe Abschnitte 4.4 und 4.6). Pharmakotherapeutische Gruppe: Immunsuppressiva, selektive Immunsuppressiva, ATC-Code: L04AA42 Inhaber der Zulassung: Novartis Europharm Limited, Vista Building, Elm Park, Merrion Road, Dublin 4, Irland. Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig. Informationen betreffend Warnhinweise und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkung mit anderen Mitteln, Nebenwirkungen und Gewöhnungseffekte sind den veröffentlichten Fachinformationen zu entnehmen. Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar. Version: 01/2020
Referenzen:
1 Mayzent Fachinformation Stand 2/2020
2 Scalfari A, Neuhaus A, Daumer M, et al. Onset of secondary progressive phase and long-term evolution of multiple sclerosis. J Neurol Neurosurg Psychiatry 2014;85:67–75
3 Rovaris M, Confavreux C, Furlan R, et al. Secondary progressive multiple sclerosis: current knowledge and future challenges. Lancet Neurol 2006;5:343–54
4 Aktuelle Mayzent® Fachinformation
AT2004817716
Promotion
