Die Hyaluronsäure zur Viskoinduktion3,4
HYALGAN® hat ein Molekulargewicht von 500-730 kDa und stimuliert die Synthese von endogener Hyaluronsäure durch Synovialzellen.3,4
Der Wirkstoff in HYALGAN® ist Natriumhyaluronat, eine Substanz, die natürlicherweise im Gelenkknorpel vorkommt und zur Schmierung und Dämpfung des Gelenks beiträgt.2
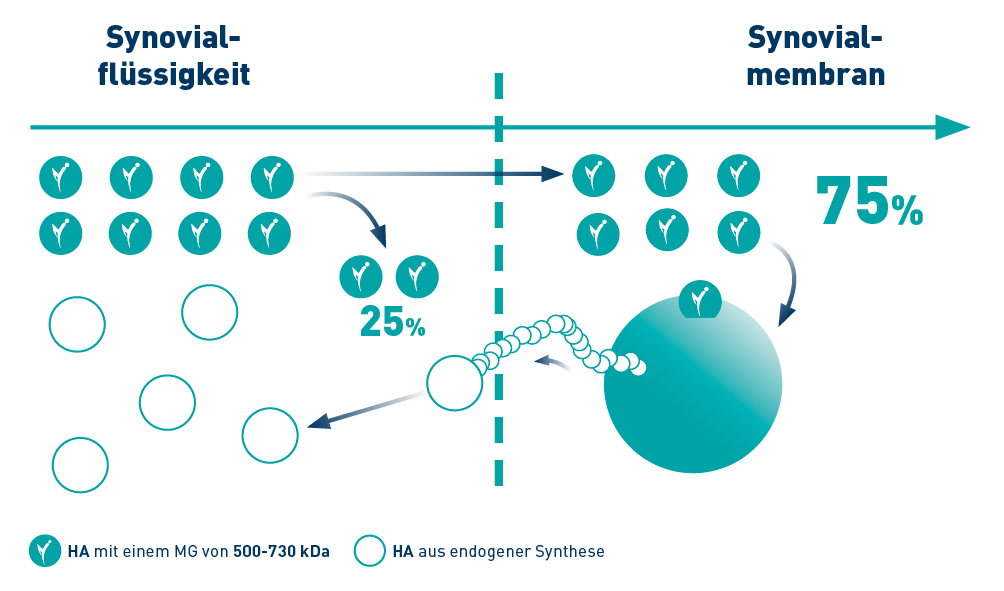 Grafische Ausarbeitung nach Referenz3,4
Grafische Ausarbeitung nach Referenz3,4
Verlangsamung des Prozesses der Osteoarthrose5
HYALGAN® verlangsamt potenziell die Osteoarthrose des Knies.
In einer Patient:innenuntergruppe mit einer leichteren Form der Gelenkerkrankung kann die Anwendung von HYALGAN® das physiologische Fortschreiten des Knorpelschadens verlangsamen.5
DMOAD*-Effekt: HYALGAN® mit nachgewiesenem Knorpelschutz6-10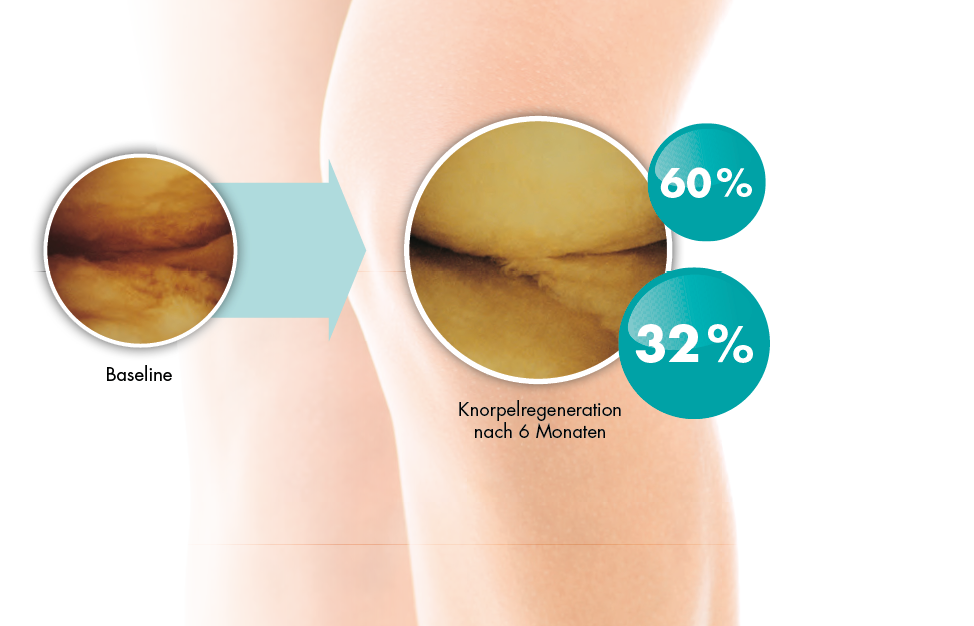
Dank des DMOAD-Effekts kann HYALGAN® den Knorpel schützen:
![]() Hemmt die Entzündungszellen7,8
Hemmt die Entzündungszellen7,8
![]() Stimuliert die endogene HA-Synthese3,4
Stimuliert die endogene HA-Synthese3,4
![]() Verbessert den Zellmetabolismus9
Verbessert den Zellmetabolismus9
HYALGAN® – die bewährte Lösung seit mehr als 30 Jahren2
 ANWENDUNGSGEBIETE
ANWENDUNGSGEBIETE
HYALGAN® Injektionslösung zur intraartikulären Injektion ist indiziert zur unterstützenden Behandlung bei Gonarthrose, Coxarthrose und Arthrose des Schultergelenks.
DOSIERUNG
2 ml HYALGAN® einmal wöchentlich über 5 Wochen, soweit vom Arzt
nicht anders verordnet.
Sollten Sie Fragen zu HYALGAN® haben, kontaktieren Sie bitte FIDIA Pharma Austria unter info@fidiapharma.at
* DMOAD: Disease Modifying Osteo-Arthritis Drug
# 7,5% Patient:innen zeigten eine Verschlechterung des Zustands.10
Referenzen:
1. Goldberg VM et al. Osteoarthritis Cartilage, 13: 216–224; 2005.
2. Fachinformation Hyalgan® Stand: Oktober 2019.
3. Smith M. M. and Ghosh P. in vitro, Rheumatology Int. (1987) 7:113-122.
4. Ghosh P. et al. Tiermodell, Seminars in Arthritis and Rheumatism, Vol 32, No 1 2002.
5. Guidolin D. et al. Eur Rev Med Pharmacol Sci. 2018; 222:4698-4719.
6. Listrat V et al. Osteoarthritis Cartilage 1997; 5: 53–160.
7. Sheehan KM et al. in vitro, Journal of Orthopaedic Research 21 (2003) 744-751.
8. Altman R et al. Cartilage 2019, Vol. 10(1) 43–52.
9. Osti et al. in vitro, BMC Musculoskeletal Disorders (2015) 16:284.
10. Frizziero L et al. Clin Exp Rheumatol 1998; 16: 441–449.
FKI Hyalgan 20 mg-Spritzampullen
Bezeichnung des Arzneimittels: Hyalgan 20 mg-Spritzampullen. Qualitative und quantitative Zusammensetzung: 1 Spritzampulle enthält 20 mg Natrium-Hyaluronat des mittleren Molekulargewichts von 650 kD. Sonstige Bestandteile: 17 mg Natriumchlorid, 0,1 mg Natriumdihydrogenphosphat-Dihydrat, 1,2 mg Natriummonohydrogenphosphat-Dodecahydrat; dies entspricht zusammen einer Natriummenge von 7,92 mg/2ml. Liste der sonstigen Bestandteile: Natriumchlorid, Natriummonohydrogenphosphat-Dodecahydrat Natriumdihydrogenphosphat-Dihydrat, Wasser für Injektionszwecke. Anwendungsgebiete: Zur unterstützenden Behandlung bei Gonarthrose, Coxarthrose und Arthrose des Schultergelenks. Gegenanzeigen: Hyalgan soll bei Überempfindlichkeit gegen Hyaluronsäure oder Hühnereiweiß oder einen der sonstigen Bestandteile nicht angewendet werden. Allgemeine Gegenanzeigen der intraartikulären Injektion, wie Infektionen oder Hauterkrankungen an der Injektionsstelle. Pharmakotherapeutische Gruppe: Mittel gegen Störungen des Muskel- und Skelettsystems. ATC-Code: M09AX01. Rezeptpflicht/Apothekenpflicht: Rezept- und apothekenpflichtig. Inhaber der Zulassung: Fidia Farmaceutici S.p.A, Via Ponte della Fabbrica 3/A, 35031, Abano Terme (PD), Italy. Stand der Information: 10/2019. Weitere Informationen zu den Abschnitten Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen, Schwangerschaft und Stillzeit und Nebenwirkungen sind der Austria-Codex- Fachinformation zu entnehmen.
FKI Hyalgan 20 mg-Stechampullen
Bezeichnung des Arzneimittels: Hyalgan 20 mg-Stechampullen. Qualitative und quantitative Zusammensetzung: 1 Stechampulle enthält 20 mg Natrium-Hyaluronat des mittleren Molekulargewichts von 650 kD. Sonstige Bestandteile: 17 mg Natriumchlorid, 0,1 mg Natriumdihydrogenphosphat-Dihydrat, 1,2 mg Natriummonohydrogenphosphat-Dodecahydrat; dies entspricht zusammen einer Natriummenge von 7,92 mg/2ml. Liste der sonstigen Bestandteile: Natriumchlorid, Natriummonohydrogenphosphat-Dodecahydrat Natriumdihydrogenphosphat-Dihydrat, Wasser für Injektionszwecke. Anwendungsgebiete: Zur unterstützenden Behandlung bei Gonarthrose, Coxarthrose und Arthrose des Schultergelenks. Gegenanzeigen: Hyalgan soll bei Überempfindlichkeit gegen Hyaluronsäure oder Hühnereiweiß oder einen der sonstigen Bestandteile nicht angewendet werden. Allgemeine Gegenanzeigen der intraartikulären Injektion, wie Infektionen oder Hauterkrankungen an der Injektionsstelle. Pharmakotherapeutische Gruppe: Mittel gegen Störungen des Muskel- und Skelettsystems. ATC-Code: M09AX01. Rezeptpflicht/Apothekenpflicht: Rezept- und apothekenpflichtig. Inhaber der Zulassung: Fidia Farmaceutici S.p.A, Via Ponte della Fabbrica 3/A, 35031, Abano Terme (PD), Italy. Stand der Information: 10/2019. Weitere Informationen zu den Abschnitten Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen, Schwangerschaft und Stillzeit und Nebenwirkungen sind der Austria-Codex-Fachinformation zu entnehmen.
ATFidia/HYALG/045/Jul/23
Promotion
